Giải bài tập hóa 10 bài 21
Nội dung bài bác giảngKhái quát lác về team halogen tìm đọc về địa điểm nhóm halogen trong bảng tuần hoàn; Sự thay đổi độ âm điện, nửa đường kính nguyên tử và một số tính chất vật lí của những nguyên tố vào nhóm; thông số kỹ thuật lớp electron ko kể cùng của nguyên tử những nguyên tố halogen tương tự nhau. đặc điểm hoá học tập cơ bản của những nguyên tố halogen là tính oxi hoá mạnh; Sự đổi khác tính hóa học hóa học của các đơn hóa học trong nhóm halogen.
Bạn đang xem: Giải bài tập hóa 10 bài 21
1. Bắt tắt lý thuyết
1.1.Vị trí của tập thể nhóm halogen trong Bảng tuần hoàn
1.2.Cấu hình electron nguyên tử, cấu trúc phân tử
1.3.Sự chuyển đổi tính chất
2. Bài tập minh hoạ
3. Luyện tập Bài 21 hóa học 10
3.1. Trắc nghiệm
3.2. Bài tập SGK và Nâng cao
4. Hỏi đáp vềBài 21 Chương 5 chất hóa học 10
Nhóm halogen có : Flo(F); Clo(Cl); Brom (Br), Iot (I), Atatin (At)Các yếu tố halogen thuộc team VIIA. Chúng đứng ngay sát cuối những chu kì, ngay lập tức trước những nguyên tố khí hiếm.
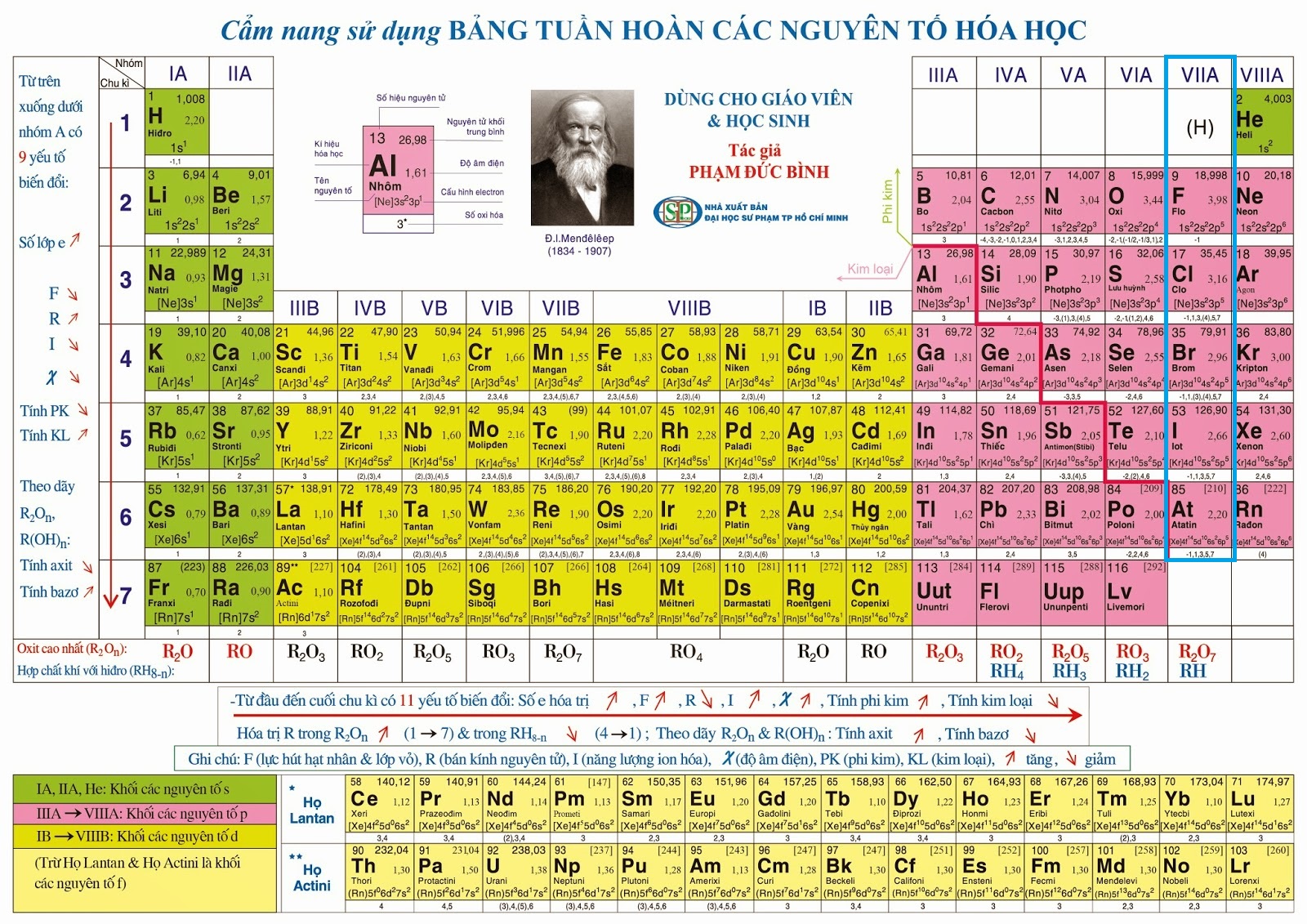
Hình 1:Vị trí của nhóm Halogen vào bảng khối hệ thống tuần hoàn
Nguyên tử gồm 7e lớp ngoài cùng (ns2 np5)Ở tâm trạng tự do, 2 nguyên tử halogen góp chung 1 e cùng với nhau sinh sản một link công hóa trị ko cực.
Xem thêm: Xem Phim Cấp 3 Mỹ Mới Nhất, Results For : Phim Cap 3 My
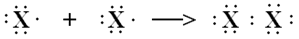
bí quyết electron
Công thức cấu tạo: X - XCông thức phân tử: X2Liên kết vào phân tử X2 ko bền lắm, dễ bị tách bóc thành 2 nguyên tử X.Trong phản nghịch ứng hoá học, những nguyên tử X dễ thu thêm 1e ⇒ đặc thù hoá học cơ bản của những halogen là tính oxi hoá mạnh.1.3.1.Sự biến hóa tính chất vật lí của những đơn chất
| Tính chất | Flo | Clo | Brom | Iot |
Số hiệu nguyên tử | 9 | 17 | 35 | 53 |
Bán kính nguyên tử (nm) | 0,064 | 0,099 | 0,114 | 0,133 |
| Cấu hình electron lớp bên ngoài cùng của nguyên tử | 2s22p5 | 3s23p5 | 4s24p5 | 5s25p5 |
| Nguyên tử khối | 19 | 35,5 | 80 | 127 |
| Trạng thái tập thích hợp của đối chọi chất sinh hoạt 200C | Khí | Khí | Lỏng | Rắn |
Màu sắc | Lục nhạc | Vàng lục | Nâu đỏ | Đen tím |
Nhiệt độ nóng chảy(0C) | -219,6 | -101,0 | -7,3 | 113,6 |
Nhiệt độ sôi | -188,1 | -34,1 | 59,2 | 185,5 |
Độ âm điện | 3,98 | 3,16 | 2,96 | 2,66 |

Hình 2:Màu sắc của F, Cl, Br, I, At của group halogen
Từ F mang lại I, ta thấy:
Trạng thái tập hợp: khí → lỏng → rắnMàu sắc: đậm dầntonc , tosôi : tăng dần1.3.2.Sự thay đổi độ âm điệnĐộ âm điện tương đối lớn.Giảm dần dần từ F mang lại IF trong những hợp chất gồm số oxi hóa là -1, những nguyên tố còn lại ngoài mức oxi hóa là -1 còn có mức thoái hóa là +1, +3, +5, +7.
⇒ vị flo gồm độ âm điện lớn số 1 chỉ hút e nên chỉ có số oxi hoá -1, các nguyên tố còn lại rất có thể tạo thành 1, 3, 5, 7 e đơn chiếc ở tâm lý bị kích thích hợp nên hoàn toàn có thể nhường 1, 3, 5, 7 e nên ngoài số oxi hoá -1 còn có thêm số oxi hoá +1, +3, +5, +7
1.3.3.Sự đổi khác tính hóa học hoá học của các đơn chấtCác 1-1 chất halogengiống nhau về đặc điểm hoá học cũng giống như thành phần và tính chất của những hợp chất bởi vì chúng tạo nên thành (Do lớp e ko kể cùng có thông số kỹ thuật tương trường đoản cú nhau ns2 np5)
Halogen là đông đảo phi kim điển hình, tính oxi hóa giảm từ F → I;
Halogen oxi hóa hầu hết các sắt kẽm kim loại tạo muối bột halogenua;
Halogen lão hóa hyđro tạo ra hợp chất khí hyđro halogenua, chất này tan trong nước sản xuất axit halogenhiđric.











